面对免疫治疗在肿瘤综合治疗体系中不断发展,专家们发现,RECIST1.1 标准可能低估免疫治疗的获益,而面临巨大挑战。相对于传统的放疗及化疗,免疫治疗具有特异性强,高效和无放化疗的毒副作用,但免疫治疗疗程长,见效慢,治疗过程中可能出现假性进展,或超进展。为了统一临床研究中评估免疫治疗疗效的评价标准,RECIST()工作小组在2017年底发布了全新标准《iRECIST: guidelines for response criteria for use in trials testing immunotherapeutics》(以下简称iRECIST),明确了免疫疗法试验中实体肿瘤测量的标准方法,提出了肿瘤大小客观变化的定义,规定了未来和 目前正在进行的试验所需的最少数据点,便于数据库的建设和后期对于iRECIST的验证。同时,《iRECIST》还有助于保证免疫疗法试验实施、解释和分析的一致性,种种特性都预示着《iRECIST》标准将在免疫肿瘤学时代大放异彩。
那 么,《iRECIST》和《RECIST1.1》有何共同点和差异之处?肿瘤疗效评估时,如何选择最合适的标准?《iRECIST》是否存在不足之处?……..您是否有所思索或疑惑呢?
《iRECIST》的由来?
《RECIST 1.1》是传统的实体瘤影像学疗效评价标准,由于其可能低估免疫治疗的获益,显示出了不足。
2009年,一种二维的疗效评价标准——《irRC》首先问世;
2013年,专家组对该标准进行简化,形成了《irRECIST》标准;
2017年,为了统一临床研究中评估免疫治疗疗效的评价标准,RECIST工作小组出台了全新标准《iRECIST》。
iRECIST 与 RECIST1.1 相 同 之 处
1) 病灶的测量方法
2) 可测量病灶的定义和靶病灶的选择
3) 不可测量病灶和非靶病灶的定义
4) 特殊病灶处理
5) 肿瘤疗效评估频率
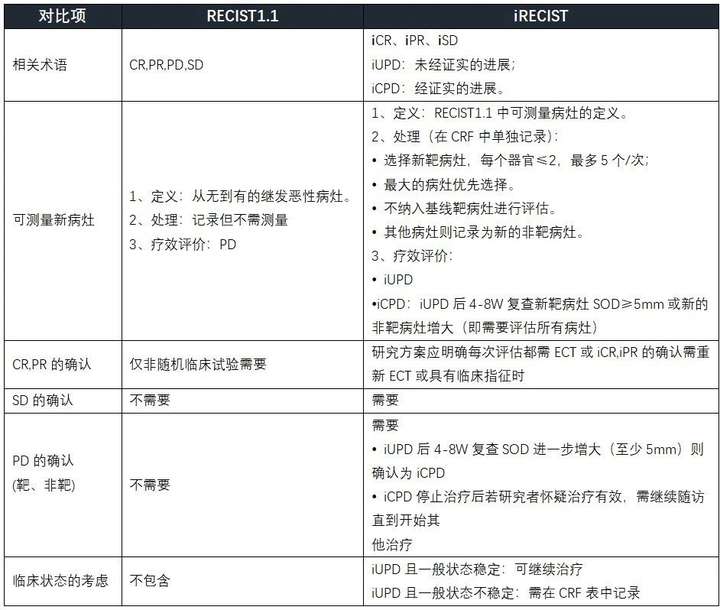 iRECIST 与 RECIST1.1 差 异 之 处
肿瘤疗效评估标准的选择
RECIST1.1 or iRECIST
1、RECIST 1.1仍旧作为主要评估标准
2、iRECIST只适用于发生RECIST 1.1 PD后并用作探索性评估标准——大多数患者不会有“假性进展”
3、iRECIST的原则非常紧密地遵循RECIST 1.1——通常情况下都是默认使用RECIST 1.1原则,除了:
4、在每一个访视点分别使用RECIST 1.1和iRECIST,两者并行评估。
iRECIST 尚待解决的问题
虽然iRECIST标准很适合解决PSPD(假性进展)问题,但是还不能完全解决HPD(超进展)问题。后者是近期从免疫肿瘤药物治疗中观察到的另一种肿瘤进展模式。
HPD(超进展)的特征是快速进展(在开始抗PD-1/PD-L1后4~6周内),可显著影响治疗结局。虽然该问题相对罕见(各型肿瘤中约占9%),但临床试验中很多患者在接受免疫治疗后,第一次疾病评价之前还是因为临床进展而被剔除研究。因此临床试验报告中没有太多相关数据。
鉴于此,iRECIST标准讨论了在试验中进行早期(即4~6周而不是治疗开始后8~12周)肿瘤评估的可能性,以便能够早发现、早治疗。
免疫治疗后影像学评价所面临的挑战
RECIST1.1无法准确评价免疫治疗反应,与传统化疗相比,免疫治疗反应模式多样,如:
完全缓解(CR)
部分缓解(PR)
疾病稳定(SD)
疾病进展(PD)
假性进展(PSPD)
超进展(HPD)
免疫相关副反应:
肺炎、类结节病样改变、甲状腺炎、结肠炎、胰腺炎、肝炎、垂体炎、肾上腺功能不全等免疫相关副反应对影像评估的影响。
欧洲癌症研究和治疗组织(EORTC,European organization for Research and Treatment of Cancer)的RECIST working group(http∶//www.eortc.org/recist/)在RECIST1.1版的基础上,结合近年来实体瘤免疫治疗的经验,2017年3月在LANCET发布了用于评价免疫治疗疗效的修订版RECIST1.1(modified RECIST 1.1 for immune-based therapeutics,简称iRECIST)
The iRECIST guideline addresses the singularities of immunotherapies, ensuring consistent trial design and interpretation of tumour progression measurements for immune modulators.
iRECIST指南解决了免疫治疗的特点,确保了对免疫调节剂治疗肿瘤进展测量的试验设计和解释的一致性。
The guideline takes into account distinctive behaviours linked to these types of therapeutics, such as delayed responses after pseudoprogression, and describes a standard approach to solid tumour measurement and definitions for objective change in tumour size which can be used in immunotherapy clinical trials.
该指南考虑了与这些类型的治疗方法相关的独特行为,如假进展后的延迟反应,并描述了实体肿瘤测量的标准方法和肿瘤大小的客观变化的定义,可用于免疫治疗临床试验。
Novel immunotherapeutics have been seen to trigger different response patterns in tumours than classic chemotherapy drugs, including the so-called ‘pseudoprogressions’, leading to concerns about assessing changes in tumours using existing tools as an objective evaluation of response to the treatment and disease progression.
与经典的化疗药物相比,新的免疫疗法已被认为可以触发肿瘤中不同的反应模式,包括所谓的“假进展”,这导致了人们对使用现有工具作为对治疗和疾病进展反应的客观评估来评估肿瘤变化的担忧。
The iRECIST approach allows responses not typically observed in traditional systemic treatment to be identified and better documented.
iRECIST方法允许识别在传统全身治疗中通常没有观察到的反应,并更好地记录下来。
The guideline describes a standard approach to solid tumour measurement and definitions for objective change in tumour size which can be used in immunotherapy clinical trials.
该指南描述了一种实体肿瘤测量的标准方法和肿瘤大小的客观变化的定义,可用于免疫治疗临床试验。
In addition, it defines the minimum amount of data to be collected in order to facilitate the creation of a data warehouse that can be used to later validate iRECIST.
此外,它还定义了要收集的最小数据量,以便于创建可用于以后验证iRECIST的数据库。
|

|