“癌症免疫循环”发生在肿瘤、淋巴结和血液当中,包括从释放抗原,到杀死癌细胞等7个步骤。 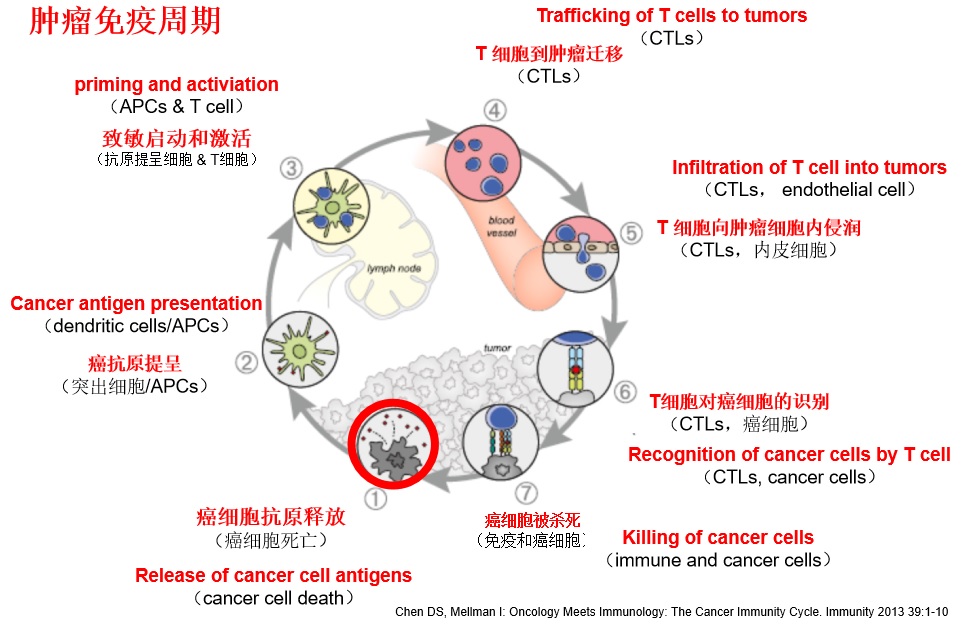 肿瘤免疫循环的第一步是在化疗、放疗、栓塞、局部消融作用下癌细胞死亡,释放各种免疫源性抗原。此时肿瘤由非免疫原性细胞变成具有免疫源性细胞,并在机体内激发抗肿瘤免疫反应 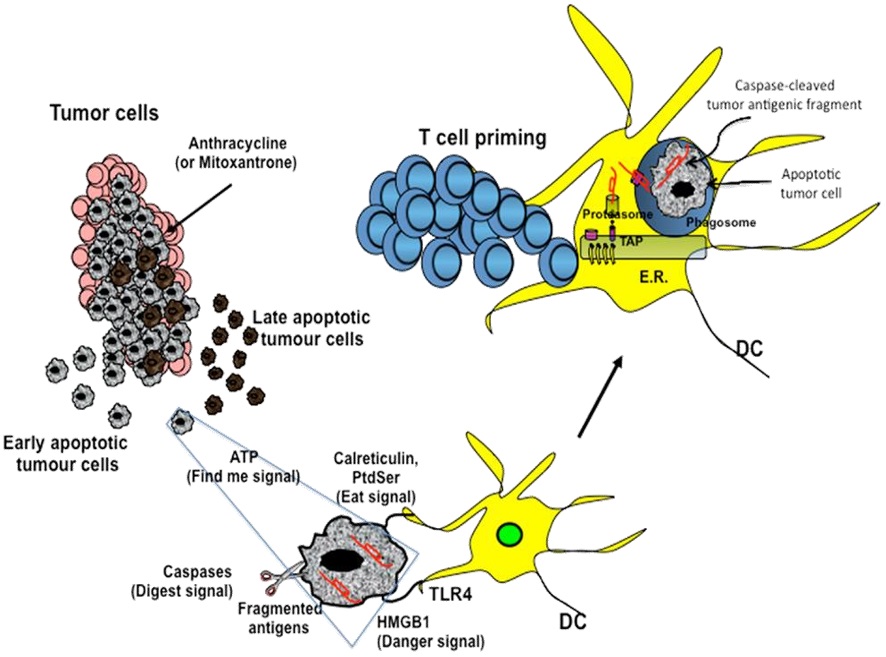
化疗(或包括放疗,TACE、局部消融...)在非特异性杀伤肿瘤细胞时可以通过多种机制增强肿瘤细胞的免疫原性,肿瘤细胞在发生死亡的同时,由非免疫原性转化为免疫原性而介导抗肿瘤免疫应答,此现象被称之为免疫原性细胞死亡(immunogenic cell death, ICD)。
用多种化学药物和放射线治疗肿瘤时,肿瘤细胞可发生免疫原性细胞死亡,即肿瘤细胞在发生凋亡的同时,由非免疫原性的细胞转变为具有免疫原性的细胞,并在机体内激发抗肿瘤免疫效应。
肿瘤细胞发生ICD时,一系列信号分子和细胞因子参与其中,包括细胞膜表面信号分子表达水平的改变,促免疫效应因子的合成与释放,此类物质被称为损伤相关分子模式(damage-associated molecular patterns, DAMP)。
程序性死亡是细胞自身受基因调控释放自溶酶一类的物质,可以看做是自杀,自身免疫是细胞作为靶细胞受T细胞攻击死亡 癌细胞死亡的类型包括
凋亡:程序性细胞死亡(细胞自杀)
APOPTOSIS: Programmed cell death (celular suicide)
- 程序性坏死(Necroptosis)是一种不同于凋亡及传统坏死的细胞程序性死亡方式,可由肿瘤坏死因子受体(Tumor necrosis factor receptor,
TNFR)或模式识别受体(Pattern recognition receptor, PRR)调控启动.受体相互作用蛋白(Receptor-interacting protein, RIP)1和3是启动 necroptosis的两个关键蛋白, necroptosis启动后需要一系列分子传递和执行死亡信号,如多核苷酸二磷酸-核糖聚合酶-1(Poly(ADP-ribose) polymerase, PARP-1),活性氧簇(Reactive oxygen species, ROS),Ca2+等,这些分子破坏线粒体及其他细胞器,最终使细胞在缺乏天冬氨 酸半胱氨酸蛋白酶(Caspase)的情况下死亡.Necroptosis 细胞可将损伤相关模式分子(Damage-associated molecular patterns, DAMPs) 暴露到细胞外,被吞噬细胞识别并清除
坏死:细胞死亡由于外部因素,如放化疗(谋杀)
NECROSIS: Cell death caused by an external agent (celular murder)
自我吞噬:灾难性有丝分裂(老死)
AUTOPHAGY, Catastrophic mitosis: SENESCENCE
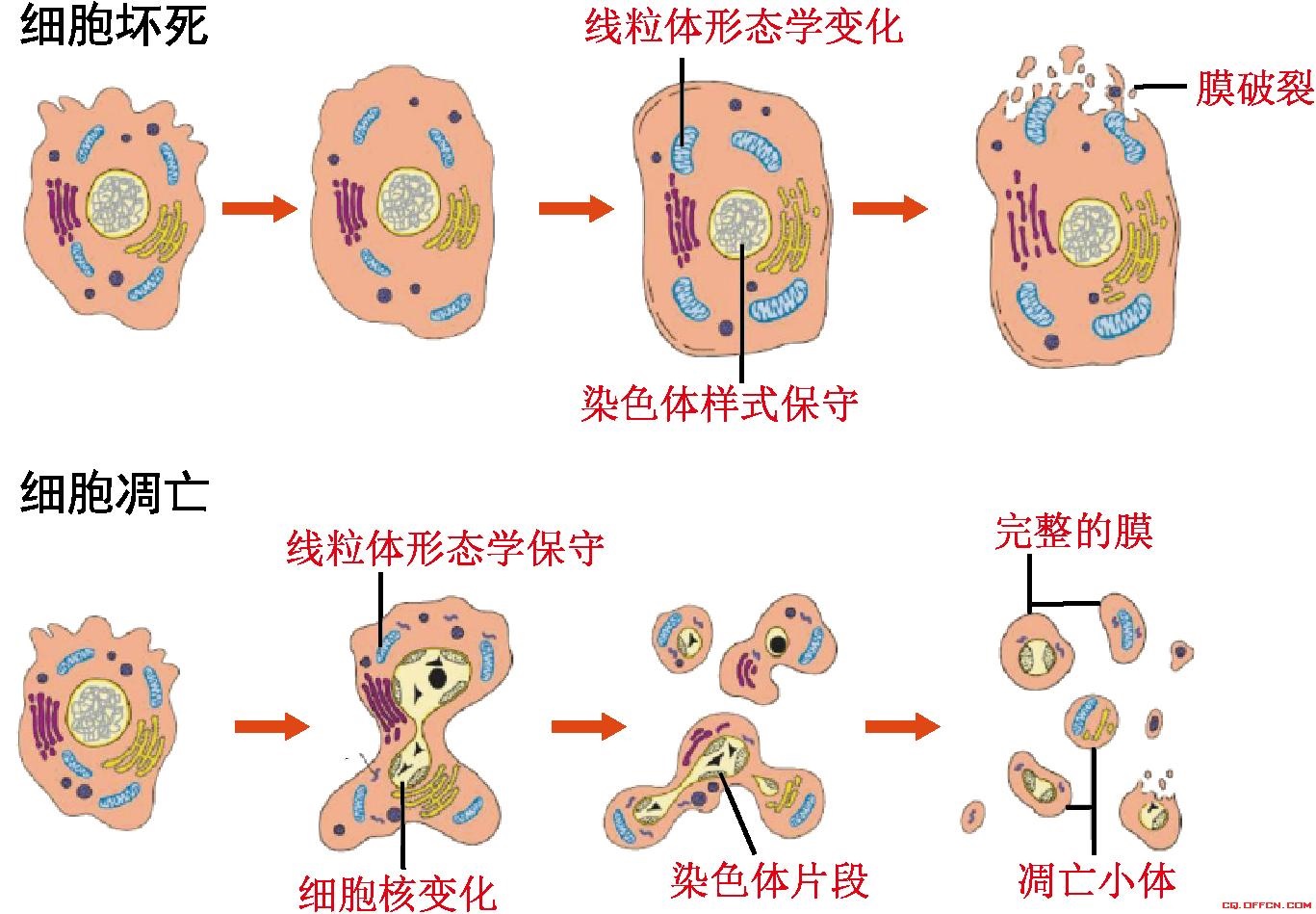
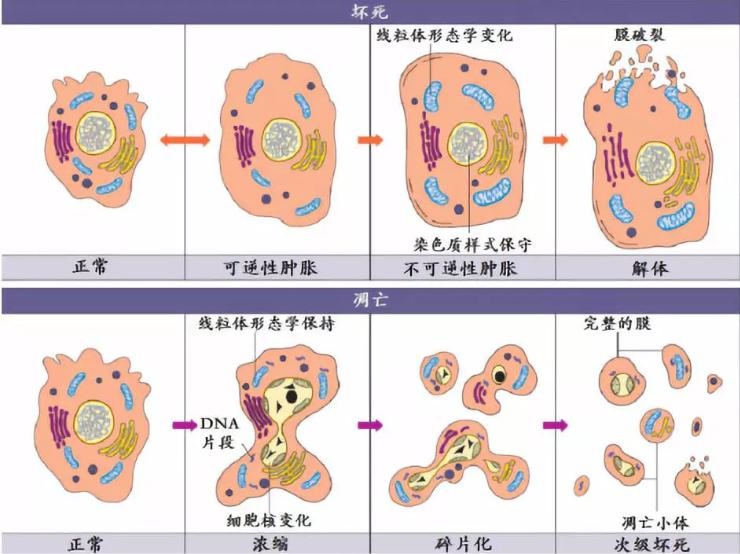
细胞凋亡,程序性细胞死亡,自杀是指为了维持内环境稳定,由基因控制的细胞自主的有序的死亡。细胞凋亡与细胞坏死不同,细胞凋亡不是一件被动的过程,而是主动过程,它涉及一系列基因的激活、表达以及调控等的作用,它并不是病理条件下,自体损伤的一种现象,而是为更好地适应生存环境而主动争取的一种死亡过程。”
人体内的细胞注定是要死亡的,有些死亡是生理性的,有些死亡则是病理性的,有关细胞死亡过程的研究,已成为生物学、医学研究的一个热点。人们已经知道细胞的死亡起码有两种方式,即细胞坏死与细胞凋亡(apoptosis)。细胞坏死是早已被认识到的一种细胞死亡方式,而细胞凋亡则是逐渐被认识的一种细胞死亡方式。
细胞凋亡是细胞的一种基本生物学现象,在多细胞生物去除不需要的或异常的细胞中起着必要的作用。它在生物体的进化、内环境的稳定以及多个系统的发育中起着重要的作用。细胞凋亡不仅是一种特殊的细胞死亡类型,而且具有重要的生物学意义及复杂的分子生物学机制。
凋亡是多基因严格控制的过程。这些基因在种属之间非常保守,如Bcl-2家族、caspase家族、癌基因如C-myc、抑癌基因P53等,随着分子生物学技术的发展对多种细胞凋亡的过程有了相当的认识,但是迄今为止凋亡过程确切机制尚不完全清楚。而凋亡过程的紊乱可能与许多疾病的发生有直接或间接的关系。如肿瘤、自身免疫性疾病等,能够诱发细胞凋亡的因素很多,如射线、药物等。
当细胞凋亡发生紊乱时,人体容易发生各种肿瘤性疾病。 细胞坏死,病理性细胞死亡,被动死亡, 谋杀细胞坏死,就是指各种原因引起的细胞的正常新陈代谢遭到破坏,导致了细胞形态学发生了改变,最终导致细胞溶解破坏,这个过程就叫做细胞坏死。细胞坏死的原因有多种,常见的有物理因素,如各种射线、各种机械性损伤等,还有以及各种放射性核素损伤。还有化学因素,常见的各种化疗药物,就可以引起肿瘤细胞和正常细胞的坏死。
- 程序性坏死(Necroptosis)是一种不同于凋亡及传统坏死的细胞程序性死亡方式,可由肿瘤坏死因子受体(Tumor necrosis factor receptor,
TNFR)或模式识别受体(Pattern recognition receptor, PRR)调控启动.受体相互作用蛋白(Receptor-interacting protein, RIP)1和3是启动 necroptosis的两个关键蛋白, necroptosis启动后需要一系列分子传递和执行死亡信号,如多核苷酸二磷酸-核糖聚合酶-1(Poly(ADP- ribose) polymerase, PARP-1),活性氧簇(Reactive oxygen species, ROS),Ca2+等,这些分子破坏线粒体及其他细胞器,最终使细胞在缺乏 天冬氨酸半胱氨酸蛋白酶(Caspase)的情况下死亡.Necroptosis 细胞可将损伤相关模式分子(Damage-associated molecular patterns, DAMPs) 暴露到细胞外,被吞噬细胞识别并清除 免疫源性坏死 ≠ 凋亡(程序性坏死)= 免疫源性坏死 ≠ 坏死 自我吞噬自体吞噬autophagy指细胞将自己细胞质的一部分(如线粒体和内质网)包围起来形成液泡(自体吞噬泡),再依靠初级溶酶体供应的水解酶将其消化。自体吞噬可由于饥饿和激素的作用等诱导产生。分为自体吞噬和异体吞噬。自噬,是一个受严格调控的细胞内容物降解和再循环的过程,参与了细胞器的代谢和再利用以及对细胞内生物能量的补充,主要表现为细胞质中出现大量包裹着细胞质和细胞器的空泡结构,以及溶酶体对空泡内成分的降解。在形态学上,即将发生自噬的细胞胞质中出现大量游离的膜性结构称为前自噬体。作为发育和动态静止的一个关键机制,细胞程序性死亡能够清理已不需要或受损的细胞。尽管细胞凋亡是了解最多的一种程序性细胞死亡过程,近期研究人员开始对自我吞噬作用有了进一步的了解。这个过程是一种高度调节、异化过程,能使细胞自己吃掉自己。有趣的是,自我吞噬还能为细胞提供在不能进行凋亡时的一种替代形式的自我毁灭。 自我吞噬在细胞死亡中的作用目前仍然存在争议,但它对了解和治疗多种人类疾病具有重要意义。 |

|