| ||||||||||||||||||||||||||||||||||||||||||||||
 |
 |
| RFA/MWA | Cryoablation |
消融模式及免疫机制:Ablation Modalities & Immune Mechanisms:
冷冻、油炸或撼动免疫调制? Freeze, Fry, or Shake Immunomodulation?
 |
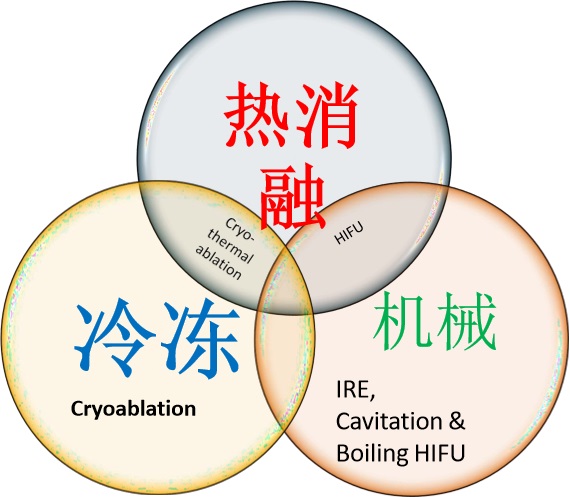 |
冷冻 Cryoablation
- 比视频消融和激光更好的增加中性粒细胞、T细胞、NK细胞 Robustly Recruits Neutrophils, T cells, NK better than RFA & Laser
- 冷冻上调 PD1 Cryo upregulates PD1
微波 MWA
- 微波弱免疫刺激并比RFA弱 MWA weak immune stimulation & less robust than RFA
但热消融比冷冻更好地调节CTL : Treg 比例 BUT heat better than cold for peripheral CTL:T Reg ratio
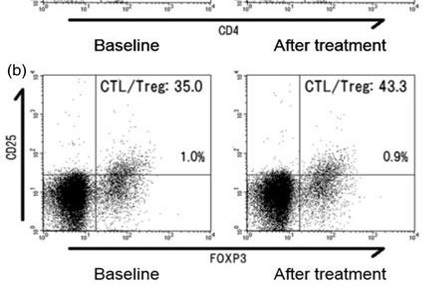 |
| 癌症免疫疗法通过增强机体免疫系统来抗击癌症,但是Treg细胞的参与会抑制免疫反应,关闭抗癌效用。 |
Am. J. Surg. 200,500–506 (2010)
Nat Rev Cancer. 2014 Mar;14(3):199-208
Liver Int. 30,1305–1314 (2010)
J Urol. 2010 183:333-8 (2010)
Surgery147, 686–695 (2010)
Ann. Surg. 231, 752–761 (2000)
J. Vasc. Interv. Radiol. 24, 1105–1112 (2013)
Min Inv Therapy & Allied Tech (2017) Erinjer
 |
|
 |
|
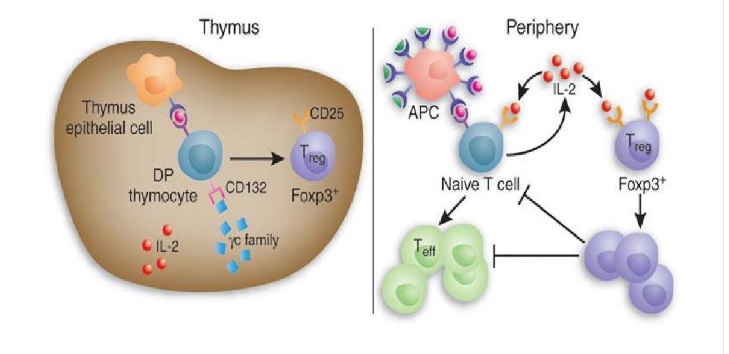
| 天然Treg | 诱导性Treg |
肿瘤免疫逃逸是导致肿瘤发生、进展的核心机制。调节性T细胞(regulatory T cell,Treg)作为调控机体免疫系统内稳态及人体自身免疫耐受的重要机制,也在肿瘤免疫的调控中扮演着重要角色
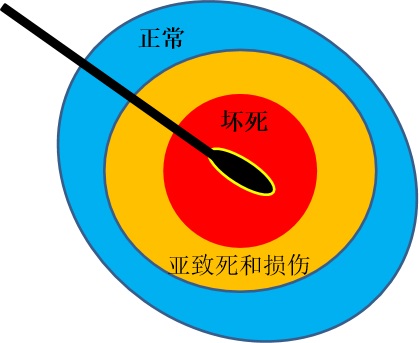
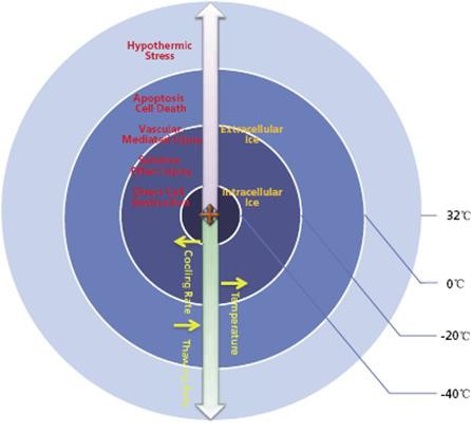
Modality –Specific Response to IO Interventions & Non-Lethal Effects
模式-对肿瘤介入和非致命效应的特定响应
肿瘤介入非致命性的效应才能引起肿瘤免疫的应答?
肿瘤介入非致命性的效应才能引起肿瘤免疫的应答?
应激反应 Stress response:
- 免疫调节,缺氧,急性炎症,细胞因子,血管生成,慢性愈合,微环境,代谢失调,细胞应激反应HSP(热休克蛋白) Immunomodulation, hypoxia, acute inflammation, cytokines, angiogenesis, chronic healing,microenvironment, metabolic dysregulation, cellular stress responses HSP(Heat Shock Proteins)
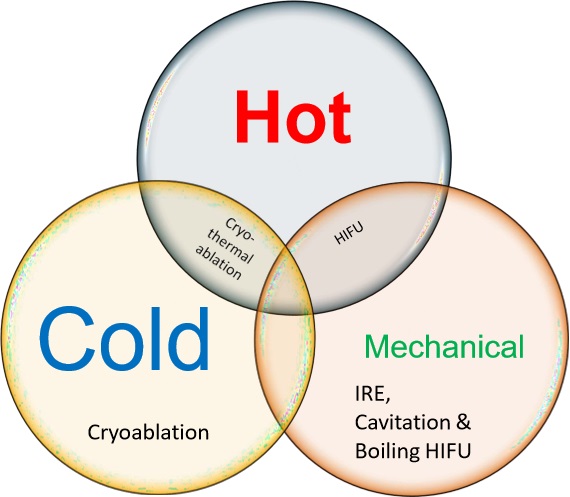
肿瘤介入方式(对肿瘤免疫)有什么不同?Are IO tools different?
- DEB-TACE:缺血-再灌注效应 Ischemia-reperfusion effects?
- 冷冻:更多的细胞因子、更多的免疫源性细胞死亡(immunogenic cell death, ICD)、
- 更多的PR1a表达?不是蛋白质变性?CRYO: more cytokines, more ICD, more PD1a expression? Proteins not denatured?
- RFA:内缘缺氧,外缘灌注多? hypoxic at inner margin, more perfusion at outer margin?
- MWA: 太快了? 热增加血液中 CTL:Treg 比值too fast? Heat increases CTL:T reg ratio in blood
- Laser: 边缘处急剧过渡:缺氧/血管生成少?sharp transition at margin: less hypoxia / angiogenesis?
- HIFU: 消融 vs 高温 vs 机械性 ablative vs hyperthermic vs mechanical?
- XRT 放疗
- IRE 不可逆电穿孔
- 联合治疗 XRT + RFA + TACE? Combination therapies:
局部区域性肿瘤介入增强癌免疫治疗
Local-Regional IO Potentiates Cancer Immunotherapy
造成炎症Create inflammation
- 细胞因子 cytokines
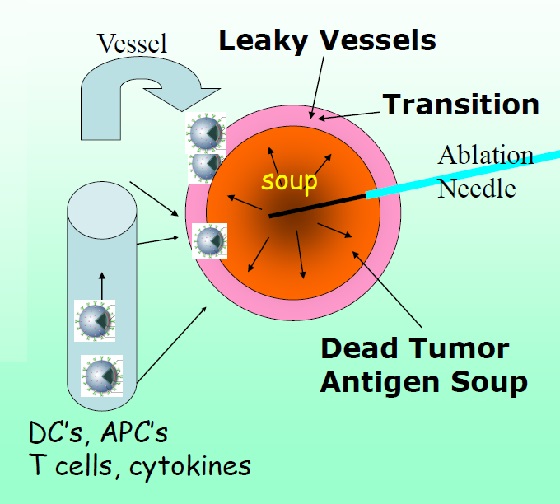
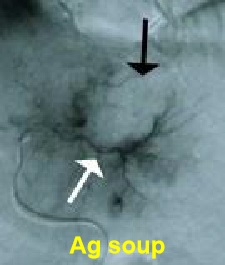
抗原汤 Antigen Soup
- 原位释放肿瘤碎片和抗原 Release tumor debris & antigens in situ
其它机制 Other mechanisms
- 增强抗原呈递细胞(APC)成熟 Enhance APC maturation
- 促进免疫细胞浸润Facilitate immunocyte infiltration
- 冷冻增强PDL1的表达 Cryo enhances PDL1 expression
- 外渗/通透性增强药物的释放 EPR: Extravasation / permeability enhances drug delivery
- 热促进血液中CTL:Treg比值 Heat promotes CTL:T reg ratio in blood
临床前:APC的和RFA联合应用
Preclinical: APC’s & RFA work together

研究提供小鼠输尿管上皮癌模型(MB 49肿瘤).,允许免疫学研究。应用射频消融。发现部分射频消融MB 49肿瘤会导致肿瘤抗原特异性的系统免疫反应,这与DC浸润增加和随后的肿瘤根除有关,并且射频消融的效果可以通过ITDC(肿瘤内树突细胞)注射来复制。从概念上讲,射频消融治疗与ITDC的结合具有吸引力,在这些实验中观察到的联合治疗缺乏协同作用可能是技术参数的结果。因此,未来的实验应该探索它们的协同潜力。最终,除了肿瘤的局部破坏外,影像引导下的恶性肿瘤治疗是一种有吸引力的辅助手段,可以改善目前的免疫治疗策略。
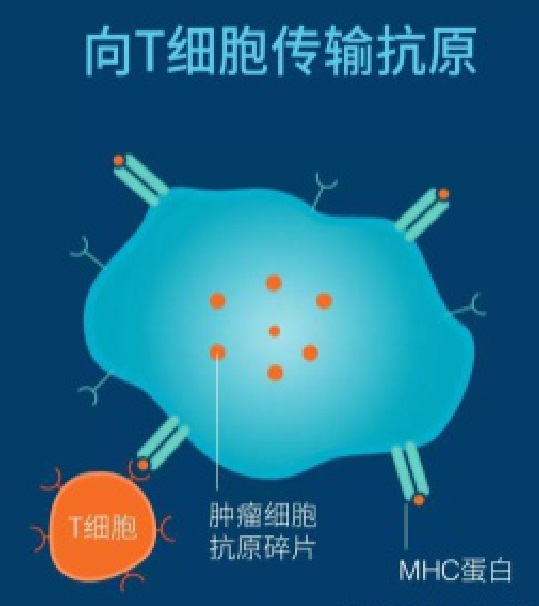
树突呈递抗原
DC’s present antigens
瘤内树突状细胞(ITDCs)
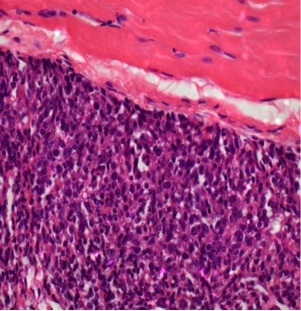
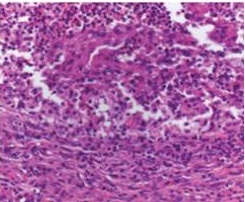
部分肿瘤消融的组织学证实。射频消融、ITDC(肿瘤内树突细胞)或联合治疗后11天,取肿瘤,纵向分离,进行苏木精-伊红染色。注意在射频消融治疗的病灶中凝血坏死与存活肿瘤之间有明显的界限,提示部分消融
射频消融边缘的抗原呈递 Antigen Presentation at Margin of RFA
DC’s present antigens
在暴露于危险信号后,DC已经成熟了
DC’s mature after exposure to danger signals
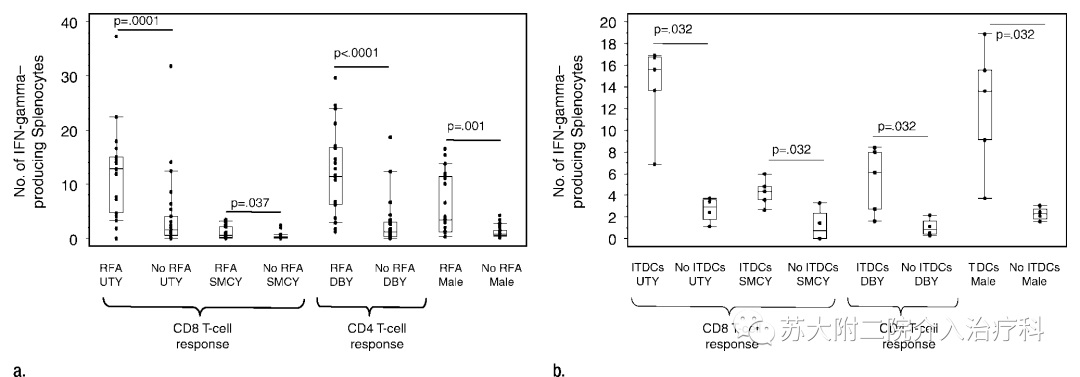
评估次全射频(RF)消融对小鼠肿瘤模型中肿瘤特异性免疫应答的影响,并探讨肿瘤内树突状细胞(ITDCs)在其中的作用。
结果1:射频消融治疗导致全身性CD8 +和CD4 +抗肿瘤免疫应答增加
在射频消融治疗,ITDCs或未治疗后14天,从每组小鼠中收集脾脏(射频消融,n = 23;无射频消融,n = 25; ITDCs,n = 5;无ITDCs,n = 4)。通过使用ELISPOT测定脾细胞的IFN-γ产生。用Wilcoxon排序和检验分析两组数据; 显示上下四分位数的中位数。
(a)与未治疗的小鼠相比,单独的RF消融导致治疗小鼠中IFN-γ反应的显著增加。
(b)与未处理的小鼠相比,单独的ITDC处理显示对HY抗原的反应显著增加。
未接受RF消融治疗的荷瘤小鼠对HY抗原肽反应较弱,尽管存在免疫反应但不足以控制进行性肿瘤生长。与未治疗的荷瘤小鼠相比,肿瘤的RF消融治疗导致显著更高的HY免疫应答
DBY=主要HY复合体(MHC)II类显性,RFA=RF消融,SMCY=MHCI类次优势,UTY=MHCI类显性。
荷瘤小鼠输尿管上皮癌模型
DC’s mature after exposure to danger signals
评估次全射频(RF)消融对小鼠肿瘤模型中肿瘤特异性免疫应答的影响,并探讨肿瘤内树突状细胞(ITDCs)在其中的作用。
结果1:射频消融治疗导致全身性CD8 +和CD4 +抗肿瘤免疫应答增加
 |
|
| (a)RF消融 | (b)ITDC注射导致全身抗肿瘤免疫应答增加。 |
在射频消融治疗,ITDCs或未治疗后14天,从每组小鼠中收集脾脏(射频消融,n = 23;无射频消融,n = 25; ITDCs,n = 5;无ITDCs,n = 4)。通过使用ELISPOT测定脾细胞的IFN-γ产生。用Wilcoxon排序和检验分析两组数据; 显示上下四分位数的中位数。
(a)与未治疗的小鼠相比,单独的RF消融导致治疗小鼠中IFN-γ反应的显著增加。
(b)与未处理的小鼠相比,单独的ITDC处理显示对HY抗原的反应显著增加。
未接受RF消融治疗的荷瘤小鼠对HY抗原肽反应较弱,尽管存在免疫反应但不足以控制进行性肿瘤生长。与未治疗的荷瘤小鼠相比,肿瘤的RF消融治疗导致显著更高的HY免疫应答
DBY=主要HY复合体(MHC)II类显性,RFA=RF消融,SMCY=MHCI类次优势,UTY=MHCI类显性。
荷瘤小鼠输尿管上皮癌模型
 |
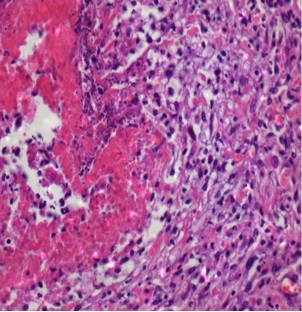 |
| 对照 | RFA |
 |
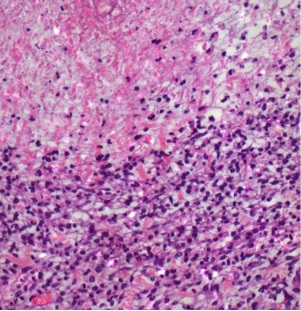 |
| 树突细胞 | RFA plus ITDC |
瘤内树突状细胞(ITDCs)
部分肿瘤消融的组织学证实。射频消融、ITDC(肿瘤内树突细胞)或联合治疗后11天,取肿瘤,纵向分离,进行苏木精-伊红染色。注意在射频消融治疗的病灶中凝血坏死与存活肿瘤之间有明显的界限,提示部分消融
射频消融边缘的抗原呈递 Antigen Presentation at Margin of RFA
 |
 |
 |
|
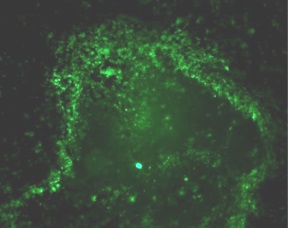
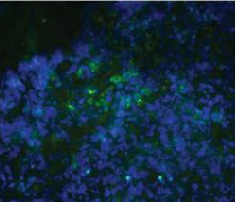
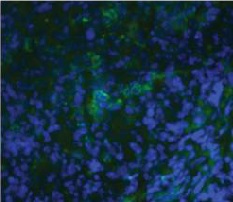
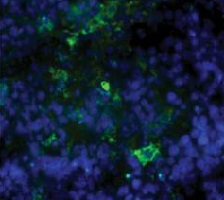
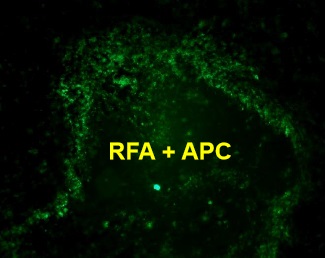
CD11C → APC (green)
|
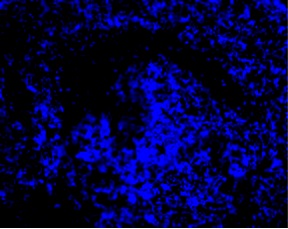
DAPI → nuclei (blue)
|
Fusion image
|
RFA plus DC CD11C IF staining
Dromi et al. Radiology 2009; 251: 58-66
 |
 |
 |
 |
| 对照 | 射频 | 树突细胞 | 射频+树突细胞 |
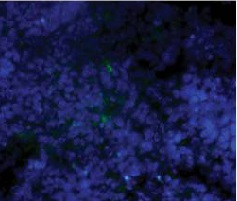
荧光显微镜下可见CD11c抗原提呈细胞(DC)在射频消融、ITDC和联合治疗后用FITC标记的CD11c抗体进行免疫组化检测。治疗后11天,取肿瘤,纵向分离,进行免疫组织化学分析。抗原提呈细胞(绿色),用4‘,6-二胺-2-苯基吲哚(蓝色)染色.对照组肿瘤中抗原提呈细胞较少。相反,射频消融、ITDC和联合治疗的肿瘤CD11c染色水平均较高,提示治疗可增强肿瘤的DC浸润。
The Action is at the Margin DEB-TACE / Thermal Ablation + Immunomodulation
作用是在DEB-TACE/热消融 边缘+免疫调节
 |
|
 |
 |
keajy vessel 渗漏的血管