| Yttrium90(90Y)经动脉放射栓塞(TARE)(也称为选择性内放射治疗)已成为治疗HCC(36-40)和其他癌症(41-45)的常用方法。电离辐射的抗肿瘤作用在很大程度上归因于它通过癌细胞(46)的直接DNA损伤来诱导肿瘤细胞死亡的能力。 除了其局部抗癌功效外,电离辐射还可能诱导免疫介导的抗肿瘤反应,被称为远隔效应(47)。强有力的证据支持电离辐射诱导免疫反应的能力,为使用辐射疗法结合基于免疫的策略(48,49)提供了依据。经肝动脉,90Y微球停滞在肿瘤微血管系统中,选择性地靶向肿瘤放射治疗,同时相对保留正常的实质(50)。TARE还能够产生炎症反应,这在手术(51)后进行的横截面成像中特别明显。90Y微球栓塞后,促炎症和氧化应激生物标记物的增加(52-54)。 其核心机制是,电离辐射诱导的细胞死亡产生了大量保存下来的肿瘤相关抗原,从而产生了一种有效的原位肿瘤疫苗(55,56)。在许多相互作用中,辐射改善抗肿瘤T细胞的树突细胞启动,增加主要组织相容性复合体1类表达,从而促进T细胞的肿瘤抗原表现(57-59)。 从辐照后的死亡肿瘤细胞中释放出来的高迁移率蛋白B1(称为HMGB1)激活toll样受体-4的途径,增加肿瘤抗原识别(60)。局部放射疗法通过促使巨噬细胞分泌一氧化氮来调节肿瘤的微环境,从而促进血管正常化、趋化因子的分泌、T细胞的招募、血管粘附分子-1的高内皮表达、提高肿瘤识别和CD8T细胞(61)的杀戮。据报道,在治疗后6-8周内,白细胞介素(IL)-6和IL-8持续增加的情况(52,54)。90y选择性栓塞方法允许最大限度用药剂量和降低毒性,也允许重复TARE(62-64),但目前仅适用于有选择的患者。 除了促进免疫力外,TARE还可能表现出一定的免疫抑制作用。TARE上调TGF-β1和银河胶素-1,已被证明间接抑制T细胞活性(61)。虽然TARE不依赖于微球的栓塞效应,但在TARE后延迟动脉相CT时,CT值单位降低了28%,这表明局部供氧量(65)可能减少。在TARE患者中已经观察到短暂性淋巴细胞减少的(66),这通常没有临床结果,但这种效应可能会干扰免疫反应。虽然TARE可以诱导肿瘤血管正常化,但它也可以通过内皮损伤和血管闭塞相关的间质性高血压来加剧局部缺氧,这在理论上降低了局部免疫反应(67,68)。虽然临床前模型支持低分隔的外照射治疗,以最大限度地提高有效的抗肿瘤免疫反应,但据我们所知,TARE这种近距离治疗的同等剂量测量还没有专门研究(69)。类似的研究对于近距离治疗是必要的,因为外照射疗法治疗肝肿瘤的临床扩展受到非肿瘤肝实质的显著放射敏感性的限制,即使技术上有向靶体积(70)提供放射剂量的改进。
主要组织相容性复合体(major histocompatibility complex,MHC) 是一组编码动物主要组织相容性抗原的基因群的统称。人类的MHC被称为HLA(human leukocyte antigen,HLA), 即人白细胞抗原;小鼠MHC则被称为H-2。HLA位于人的6号染色体短臂上,H-2位于小鼠的17号染色体上。
MHC可以分为经典MHC与非经典MHC两类,经典MHC包括MHC I、MHC II、MHC III基因,分别编码MHC I分子、MHC II分子、MHC III分子。
toll 样受体-4,TLR能结合机体自身产生的一些内源性分子(即内源性配体)。免疫佐剂可增强抗肿瘤免疫,其分子和细胞机制得到进一步阐明TLR也在其中扮演重要角色。由于肿瘤在发生发展过程中可以产生一些能被TLR识别的内源性配体,所以TLR在肿瘤免疫监视中可能发挥了一定作用。 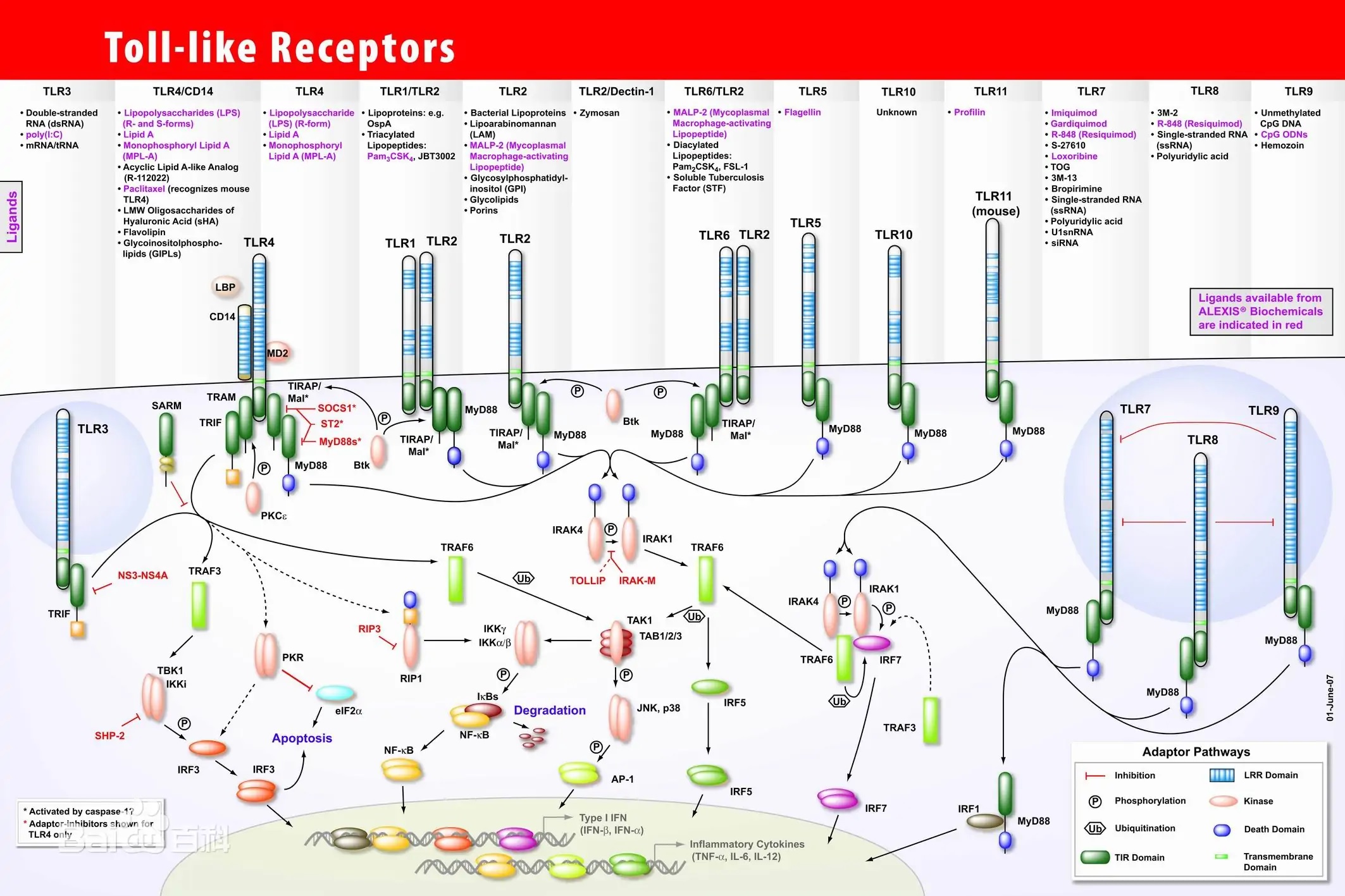 |

|