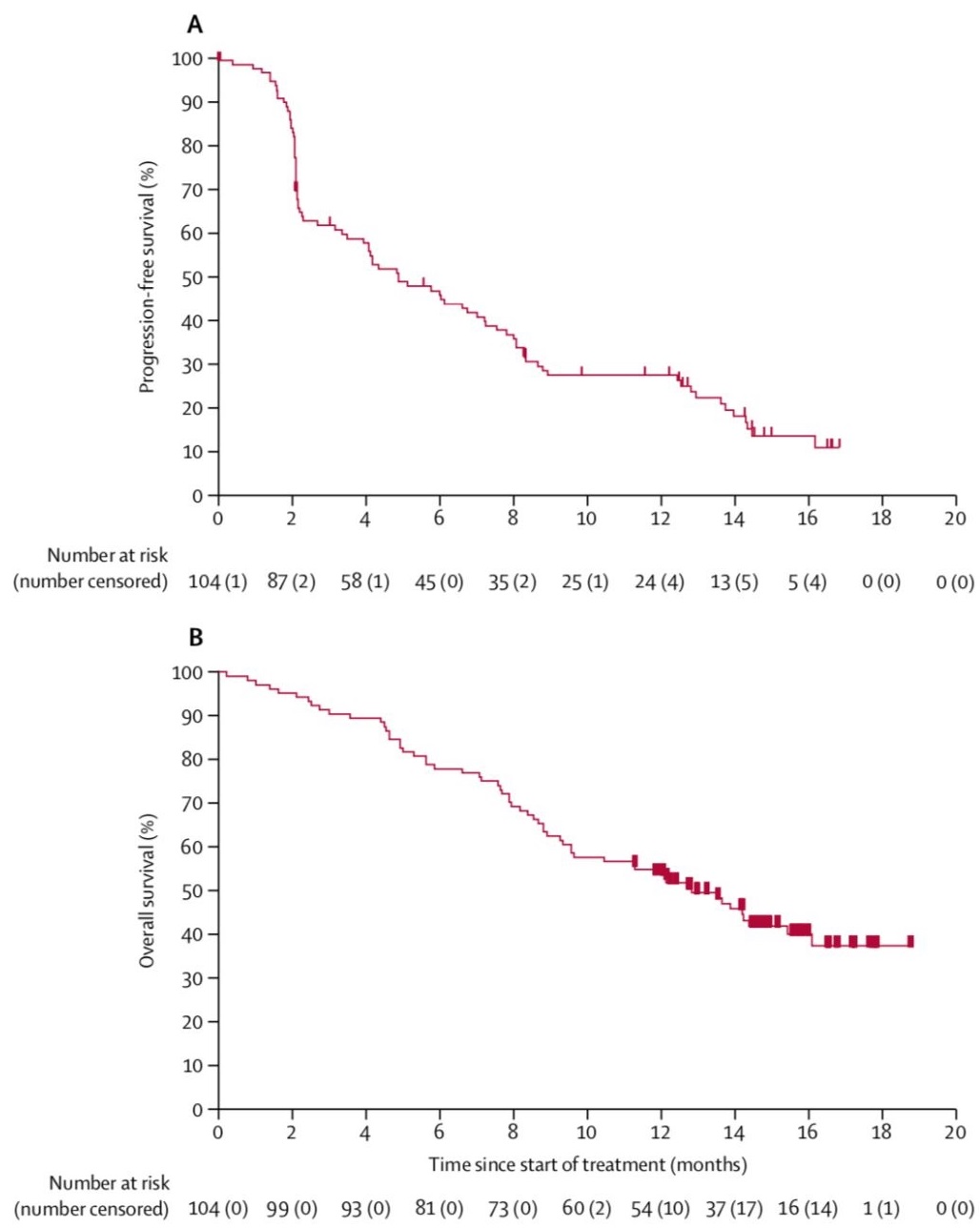
研究背景:免疫检查点阻断疗法在晚期肝癌患者中显示出良好的疗效。我们的目的是评估帕博利珠单抗(即K药)在该患者群体中的有效性和安全性。这是第一个显示派姆单抗在先前接受索拉非尼治疗的晚期肝细胞癌患者中的临床疗效和安全性的研究。 晚期肝细胞癌的治疗方法很少。一线索拉非尼和二线瑞戈非尼疗法已获批准;然而,这些疗法具有效力中等并有相关毒性。因此,迫切需要开发其他治疗策略并鉴定可预测这些患者治疗反应的生物标志物。免疫疗法,包括免疫检查点抑制剂疗法,已在肝细胞癌患者中显示出令人鼓舞的初步结果,并且程序性细胞死亡蛋白1(PD-1)抑制剂纳武单抗在美国已获得加速批准用于二线治疗。 研究:KEYNOTE-224是一项非随机、多中心、开放标签的二期试验,在10个国家的47个医疗中心和医院进行。 符合条件的患者: 1. 病理证实为肝细胞癌 2. 曾接受索拉非尼治疗,对该治疗不耐受或治疗后出现影像学进展 3. 美国东部肿瘤合作组评分标准表现为0-1分; 受试者每3周静脉注射200毫克帕博利珠单抗,持续约2年,直到病情进展、不可接受的毒性、患者退出或研究人员做出决定。 主要终点为客观反应率(ORR),定义为所有接受至少一剂帕博利珠单抗的患者中出现完全或部分应答的比例,该比例由中心评审的实体瘤1.1版反应评价标准进行影像学证实。 次要终点 对所有接受治疗的患者的安全性也进行了评估。该试验正在进行中,但不接受新患者入组,研究注册号为NCT02702414。 结果:在2016年6月7日至2017年2月9日期间,我们筛选了169例晚期肝细胞癌患者,其中104例符合条件的患者入选并接受治疗。截至2018年2月13日的数据截止日期,17(16%)名患者仍在接受帕博利珠单抗治疗。我们记录了104例患者中18例(17%;95%可信区间11-26)的客观反应率。 1. 最好的总体反应是1例(1%)完全缓解 2. 17(16%)部分缓解; 3. 46(44%)名患者病情稳定, 4. 34(33%)名患者病情进展 5. 6(6%)名患者在截止日期没有进行基线后评估,被认为是不可评估的。 104例患者中76例(73%)发生治疗相关不良事件, 1. 16例(15%)发生严重不良事件。 2. 25名(24%)发生了3级治疗相关事件; 3. 7名(7%)患者的天冬氨酸转氨酶浓度升高、 4. 4名(4%)患者的丙氨酸转氨酶浓度升高 5. 4名(4%)患者的疲劳。 6. 1例(1%)4级治疗相关的高胆红素血症事件。 7. 1.例与溃疡性食管炎相关的死亡归因于治疗。 8. 3例(3%)免疫介导型肝炎发生,但没有病毒爆发的报道。
解释:在曾接受索拉非尼治疗的晚期肝细胞癌患者中,帕博利珠单抗是有效且耐受的。这些结果表明,帕博利珠单抗可能是这些患者的治疗选择。该药物作为肝细胞癌患者的二线治疗,可通过在两个3期临床随机试验中进一步评估。

KEYNOTE-224试验是朱秀轩教授在麻省总医院癌症中心肝癌研究项目主任位置上牵头的全球多中心临床试验之一,为全球的肝癌患者带来了肝癌二线治疗的新希望。
中位生存期(Median Survival Time,MST)又称半数生存期,即当累积生存率为50%时所对应的生存时间,表示有且只有50%的生病个体可以活过这个时间。通俗地讲,就是指病人经过某种药物或治疗手段治疗时,只剩下一半(50%)的病人的生存时间。如果有9个病人(奇数),按生存期从短到长排列,第5个病人的生存时间就是中位生存时间;如果有10个病人(偶数),按生存期从短到长排列,第5、6个病人的生存时间就是中位生存时间。换句话,表示有且只有50%的个体可以活过这个时间。 比如共1000人参加临床试验,将每个人的生存时间按从小到大排名,第501人的生存时间为18个月,即表明该临床试验的中位生存期为18个月。如果是评估某个癌种的中位生存期,一般从发现该肿瘤开始计算;如果是评估某项临床试验的中位生存期,一般从给药或随机开始。 |

|