|
|
|
|
|
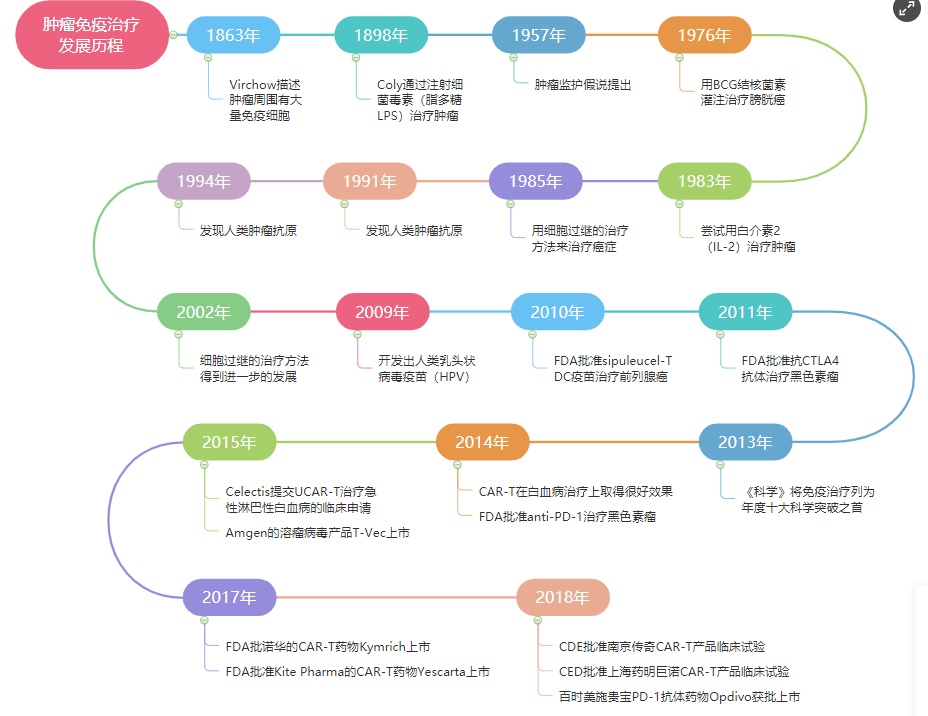
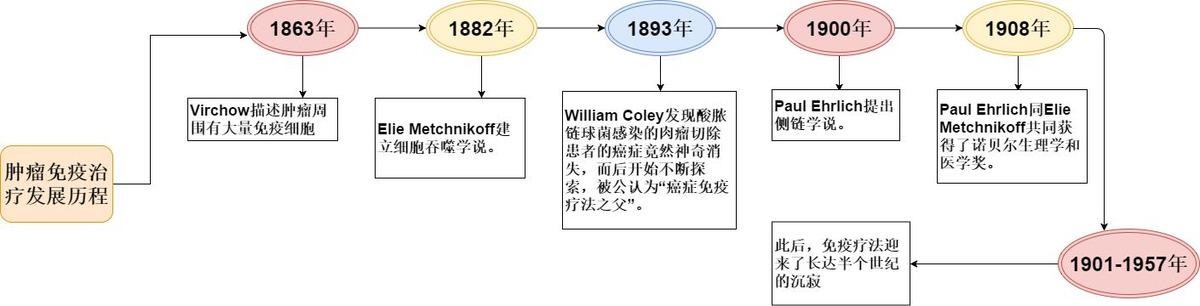
1863 |
慢 性炎症假说 |
国一名叫Virchow的医生,首先描述了癌症周围有大量的免疫细胞,尤其是肿瘤浸润淋巴细胞。因此,他提出癌症是起源于慢性炎症的这一假说。 |
|
1882 |
细胞吞噬学说 |
Elie Metchnikoff首先发现吞噬细胞,并在此后长达数十年的时间内一直研究吞噬细胞,并建立起了细胞吞噬学说。 |
|
1893 |
肿瘤免疫治疗的诞生 |
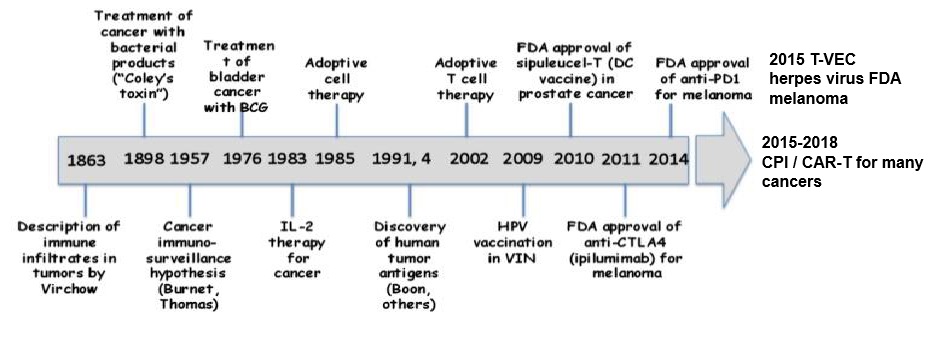
通常认为,“癌症免疫疗法之父”是美国纽约著名的骨科医生William Coley。1893年,William Coley意外发现有个患者左面颊部长了一个鸡蛋大小的肉瘤,但在术后3个月后他的脸上又长出一个鸽子蛋大小的肿瘤,再次切除后第2年,他的左耳后出现约11公分大小,像葡萄串样的复发肿瘤,并且术后伤口迟迟不能愈合,甚至还引起严重的丹毒感染,伴随反复高热发生。但随着一次次高热的出现,肉瘤竟然奇迹般地缩小直至消退。后来,科学家们发现这一现象源于细菌感染刺激了机体的免疫系统,增强了免疫力从而杀灭了肿瘤。1898年,William Coley医生通过注射细菌的毒素(脂多糖)来治疗癌症。虽然这种被称为“科利毒素”疗法有一定疗效,但受制于毒副反应级疗效等原因无法发展到今天,但此后便翻开了肿瘤免疫治疗新的篇章。此后,免疫疗法迎来了长达半个世纪的沉寂,在这个过程中,人们如同在慢慢长夜中寻找光明,等到下一个星星之火燎原。 |
|
1900 |
侧链学说 |
1900年,德国药学家Paul Ehrlich提出了侧链学说。由此,人类第一次构建了抗原抗体学说,这为人类认识免疫打下了坚实的基础。 |
|
1908 |
人类免疫学框架正式建立 |
1908年,Paul Ehrlich同Elie Metchnikoff共同获得了诺贝尔生理学和医学奖,由此,人类免疫学框架正式建立起来 |
|
1957 |
肿瘤免疫监视学说 |
直到1957年,澳大利亚免疫学家Frank Macfarlane Burnet等提出“肿瘤免疫监视学说”,并经过实验证实,该理论认为免疫系统具有完备的监视功能,能够区分“自己”和“非己”,肿瘤中存在肿瘤抗原,能够被淋巴细胞视为“非己”而清除,这就表明了肿瘤免疫治疗的合理性。打个简单的比方:免疫系统好似守护我们人体的军队、经常,外界的细菌和病毒如同外来入侵的敌人,机体内部的细胞可突变为肿瘤,如同内部破坏者,免疫系统可以起到对外可御敌,对内可维稳的作用。因此,肿瘤免疫监视学说一直被认为是癌症免疫治疗和免疫预防的理论基础。 |
 |
|
在1984年,肿瘤生物治疗(免疫治疗)被确认为第四大治疗手段后,经过近30年的发展过程,其地位日益突出,备受医学界所重视。各式各样的免疫治疗方法,归根结底都着手于“促进免疫正调控,抑制免疫负调控”两方面,这与传统医学的“补阳抑阴”“扶正祛邪”思想有异曲同工之处。 |
|
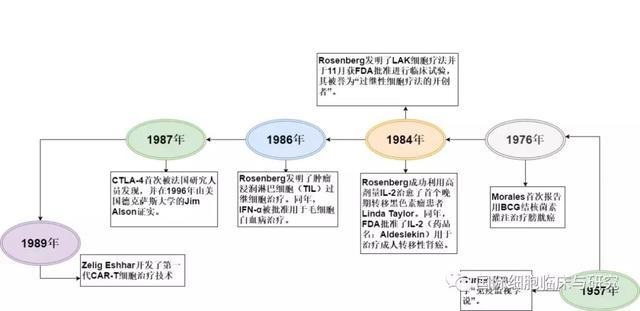
1976 |
卡介苗 |
1976年,Morales等学者采用卡介苗(BCG)结核菌素灌注治疗浅表性膀胱癌。BCG作为免疫佐剂,能够激活有关细胞,主要是激活巨噬细胞,间接激活T细胞,这种疗法在今天依然非常有效。 |
|
1984 |
IL-2 |
1984年,美国国家癌症中心Steven A.Rosenberg成功利用高剂量IL-2治愈了首个晚期转移黑色素瘤患者Linda Taylor,这是人类历史上第一个被免疫疗法治愈的癌症患者。同年,FDA批准了IL-2(药品名:Aldeslekin)用于治疗成人转移性肾癌,这是人类历史上首个获批的免疫疗法药物。 |
|
1984 |
过继性细胞疗法 |
Rosenberg发明了LAK细胞疗法并于11月获FDA批准进行临床试验,其被誉为“过继性细胞疗法的开创者”。 |
|
1986 |
过继细胞治疗 |
Rosenberg发明了肿瘤浸润淋巴细胞(TIL)过继细胞治疗。同年,IFN-α被批准用于毛细胞白血病治疗,这是第一个被批准的现代癌症免疫疗法。 |
|
1987 |
CTLA-4 |
1987年,CTLA-4首次被法国研究人员发现,并在1996年由美国德克萨斯大学的Jim Alson证实:抑制CTLA-4可以帮助释放免疫系统的杀伤能力,从而可以更有力杀伤癌细胞。 |
|
1989 |
CAR-T细胞 |
以色列魏茨曼科学研究所的化学家兼免疫学家Zelig Eshhar开发了第一代CAR-T细胞治疗技术,首次开创性地解决了会输的T细胞无法靶向解决肿瘤细胞的难题。
|
 |
|
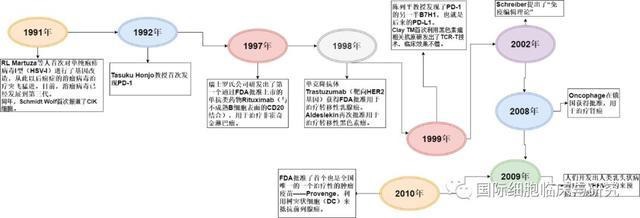
1991 |
溶瘤病毒 |
1991年,美国哈佛大学RL Martuza等人首次对单纯疱疹病毒I型(HSV-I)进行了基因改造,从此以后癌症的溶瘤病毒治疗突飞猛进。目前,溶瘤病毒已经发展到第三代。同年,美国斯坦福大学Schmidt Wolf首次报道了CIK细胞。 |
|
1992 |
发现PD-1 |
1992年,日本京都大学Tasuku Honjo教授首次发现PD-1,为以后PD-1药物的上市打下坚实的理论基础。 |
|
1997 |
Rituximab |
1997年,瑞士罗氏公司研发出了第一个通过FDA批准上市的单抗类药物Rituximab(与不成熟B细胞表面的CD20结合),用于治疗非霍奇金淋巴瘤,随后越来越多的单克隆抗体药物走向临床。 |
|
1998 |
靶向HER2 |
1998年,单克隆抗体Trastuzumab(靶向HER2基因)获得FDA批准用于治疗转移性乳腺癌。同年,Aldeslekin再次批准用于治疗转移性黑色素瘤。 |
|
1999 |
PD-L1 |
1999年,美国耶鲁大学的陈列平教授发现了PD-1的另一半B7H1,也就是后来的PD-L1。Clay TM首次利用黑色素瘤相关抗原研发出了TCR-T技术并在患者的临床研究中取得不错的治疗效果。 |
|
2002 |
免疫编辑理论 |
2002年,Schreiber提出了“免疫编辑理论”,认为肿瘤发生需要经过免疫监视、免疫平衡和免疫逃逸三个阶段,将癌症免疫治疗的理论大幅度完善。 |
|
2008 |
|
2008年世界上第一个肿瘤治疗性疫苗Oncophage在俄国获得批准,用于治疗肾癌。 |
|
2009 |
|
2009年,人们开发出人类乳头状病毒疫苗(HPV)的来预防子宫颈癌,这是第一个肿瘤癌症预防的疫苗。 |
|
2010 |
|
2010年,FDA批准了首个也是唯一的一个治疗性的肿瘤疫苗——Provenge(sipuleucel-T),利用树突状细胞(DC)来抵抗前列腺癌。它能够刺激机体产生针对肿瘤的特异免疫。现在这款DC疫苗依然在临床上来治疗前列腺癌,效果不错。此后DC疫苗开始进入白热化阶段引领癌症的迅速发酵。 |
 |
|
近几年来,以免疫调节点阻断剂为代表的药物(如抗CTLA-4单克隆抗体、阻断PD-1/PD-L1的单克隆抗体)已经陆续在多种肿瘤中效果明显,已经被批准临床应用。过继细胞免疫治疗,尤其是肿瘤浸润淋巴细胞(TIL)和基因修饰的T细胞(如CART),在黑色素瘤和白血病患者中疗效显著,有望日后正式走向临床。 |
|
免疫治疗迅速发展阶段
|
|
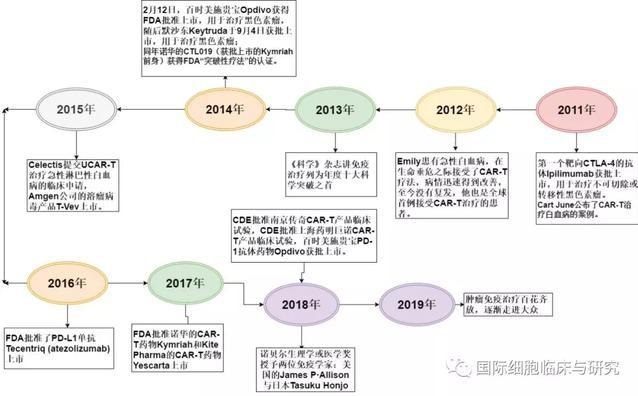
2011 |
Ipilimumab获批上市 |
2011年,第一个靶向CTLA-4的抗体Ipilimumab获批上市,用于治疗不可切除或转移性黑色素瘤。以前的抗肿瘤药物都是对抗单个肿瘤,而免疫疗法往往在多个肿瘤中均可起效。 |
|
CAR-T治疗白血病 |
同年,被誉为“CAR-T免疫治疗之父”的Cart June公布了CAR-T治疗白血病的案例,全球超过800家媒体报道了这一振奋人心的事件。 |
|
2011 |
诺贝尔生理或医学奖 |
Bruce Beutler和Jules Hoffmann关于“先天免疫激活方面的发现”的研究 |
|
Ralph Steinman在“树枝状细胞及其在获得性免疫中作用的发现”中的研究,均对癌症的免疫治疗的发展意义重大。 |
|
2012 |
|
与《Nature》同样权威而著名的《Science》杂志展望来年科学进展,认为将有6大科学领域最值得关注,其中就包括癌症免疫治疗。 |
|
2013 |
|
2013年末,《Science》在评选整个自然科学领域的十大突破时,癌症的免疫治疗位列榜首。 |
|
2014 |
Opdivo |
2014年,2月12日,百时美施贵宝Opdivo获得FDA批准上市,用于治疗黑色素瘤,这是全球首个获批上市的PD-1抗体 |
|
Keytruda |
默沙东Keytruda于9月4日获批上市,用于治疗黑色素瘤; |
|
Kymriah |
同年诺华的CTL019(获批上市的Kymriah前身)获得FDA“突破性疗法”的认证 |
|
2015 |
UCAR-T |
2015年,法国生物科技公司Celectis公司提交UCAR-T治疗急性淋巴性白血病的临床申请,这是首个异体移植的CAR-T疗法的临床试验。 |
|
T-Vev |
同年10月,Amgen(安进)公司的溶瘤病毒产品T-Vev正式上市,号称世界首个溶瘤病毒产品,标志着溶瘤病毒技术已经成熟正式走向应用。 |
|
2016 |
PD-L1单抗 |
FDA批准了PD-L1单抗Tecentriq (atezolizumab)上市,用于治疗铂类药物化疗后疾病进展或术前/术后接受铂类药物化疗12个月内疾病恶化的局部晚期或转移性尿路上皮癌患者。 |
|
2017 |
Kymriah |
2017年8月31日,诺华的CAR-T药物Kymriah获FDA批准上市,用于治疗复发或难治性B细胞急性淋巴细胞白血病的儿童和25岁以下成人患者,系全球首例获批的CAR-T疗法; |
|
Yescarta |
10月18日Kite Pharma公司的CAR-T药物Yescarta获FDA批准上市,用于治疗对前期至少其他疗法反应效果较差或治疗后复发的大B细胞淋巴瘤的成人患者。 |
|
2017 |
南京传奇 |
2017年12月8日,南京传奇递交了中国第一款CAR-T产品临床试验。2018年3月12日,国家药品审评中心(CDE)正式批准了南京传奇的临床试验申请,此后中国CAR-T研发开始大踏步进入临床试验阶段。 |
|
2018 |
诺贝尔生理学或医学奖授 |
2018年诺贝尔生理学或医学奖授予两位免疫学家:美国的詹姆斯·艾利森(James P·Allison)与日本的庶佑(Tasuku Honjo) ,以表彰他们“发现负性免疫调节治疗癌症的疗法方面的贡献”。 |
|
2018 |
CDE |
2018年6月15日,CDE批准百时美施贵宝Opdivo获批上市,用于治疗非小细胞肺癌,成为首款在中国获批上市的PD-1抗体; |
|
6月25日,上海药明巨诺的CAR-T产品获得CDE批准,为国内首例以CD19为靶点的CAR-T临床试验(南京传奇的靶点为BCMA); |
|
7月25日,默沙东Keytruda获批进入中国,用于治疗黑色素瘤,成为第二款获批上市的PD-1抗体。 |
|
2019 |
|
2019年3月8日,美国FDA加速批准了全球首个用于三阴性乳腺癌免疫治疗的药物——Tecentriq(atezolizumab,阿特珠单抗)联合化疗(Abraxane[白蛋白结合型紫杉醇],nab-paclitaxel),用于一线治疗PD-L1表达阳性且无法行切除手术的局部晚期或转移性三阴性乳腺癌。 |
|
|
|
2019年美国临床肿瘤学会(ASCO)公布的PD-1药物Pembrolizumab(商品名Keytruda,俗称“K药”)治疗初治(PD-L1 1%~49%)或经治(PD-L1≥50%)晚期非小细胞肺癌(NSCLC)的5年生存率分别为15.7%、29.6% |
|
|
|
2019年ASCO大会上,PACIFIC研究又公布了最新的研究数据,durvalumab治疗晚期NSCLC的3年总生存率达到57%(安慰剂组为43.5%),并且预期5年总生存率可达50%,这意味着该药有望让近50%的Ⅲ期不可切除的NSCLC患者实现“临床治愈”。 |
|
|
|
2019年7月31日,默沙东(MSD)宣布Keytruda获得FDA批准,作为治疗复发性局部晚期或转移性试管令状细胞癌患者的单一疗法。 |
|
|
|
2019年ESMO大会上公布的EV-103研究,可采用enfortumab vedotin +K药一线治疗无法耐受铂类的晚期尿路上皮癌患者,其有效率高达71%,疾病控制率高达93%,其中13%的患者出现完全缓解。 |
|
|
|
2019年ASCO大会一项日本采用瑞戈非尼联合纳武利尤单抗(俗称“O药”)治疗微卫星稳定(MSS)型晚期胃癌和结直肠癌的研究,其有效率为40%,疾病控制率高达88%。 |
 |
|
虽然肿瘤免疫治疗发展的道路曲折而艰难,免疫疗法适用的人群及有效率也有限,医学研究的不断发展,未来免疫疗法或许能够真正地将肿瘤变成“慢性病”。 |
|
2020 |
Tecentriq |
中国药监局正式批准了罗氏旗下重磅肿瘤免疫创新药物atezolizumab(Tecentriq)联合化疗用于一线治疗广泛期的小细胞肺癌,同时这款药物也有了自己的中国名字-泰圣奇(阿替利珠单抗),这是泰圣奇在中国获批的第一个适应症,对于国内小细胞肺癌患者来说具有重大意义:
这是目前国内第一款也是目前唯一一款联合化疗用于小细胞肺癌一线治疗的药物;
30年来广泛期小细胞肺癌一线治疗的首次重大突破,免疫疗法成为广泛期小细胞肺癌的一线治疗新标准。
|
|
|
CAR-T细胞治疗肝癌 |
由上海交通大学医学院附属仁济医院肿瘤介入科科主任翟博教授团队等共同完成相关研究,率先聚焦CAR-T细胞治疗的安全性研究。以GPC3为靶点的CAR-T细胞治疗晚期肝细胞癌(HCC)的I期临床研究结果“面世”:治疗的安全性和有效性均获得了令人期待的结果。
在两项前瞻性I期研究中,患有晚期GPC3 + HCC的成年患者(Child-Pugh A)在环磷酰胺和氟达拉滨诱导的淋巴清除后接受了自体CAR-GPC3 T细胞疗法。
截止到2019年7月24日,共有13例患者接受了中位值为19.9×108的CAR-GPC3 T细胞。所有患者均为GPC3阳性,均接受过手术治疗、局部治疗或全身性的系统治疗,都携带乙型肝炎病毒(HBV)。
其中有2例患者获得部分缓解(PR),所有患者6个月、1年和3年的生存率分别为50.3%、42.0%和10.5%,中位生存时间(OS)为278天(39.7周)。
|
|
|
Opdivo获批 |
2020年3月13日,百时美施贵宝中国官方宣布重磅好消息:欧狄沃获批成为中国首个胃癌免疫肿瘤治疗药物。中国国家药品监督管理局正式批准欧狄沃(纳武利尤单抗注射液)用于治疗既往接受过两种或两种以上全身性治疗方案的晚期或复发性胃或胃食管交界腺癌患者。自此,中国晚期胃癌患者终于迎来了免疫治疗新时代!
ATTRACTION-2的研究结果证实,opdivo用于胃癌三线或三线以上治疗安全性良好,且这部分患者一旦获益,其中有61.3%患者的生存期可延长2年以上。
|
|
|
TILs疗法 |
在今年举行的AACR会议上,一项由美国知名癌症中心莫菲特癌症研究中心(H. Lee Moffitt )开展的基于TILs细胞治疗的Ⅰ期临床结果公布:
这项试验共有32名患者参加,最终有16名患者接受TILS治疗,其中12名患者可以评估。在平均随访1.4年时,3名患者病情缓解,其中两名完全患者,并且已超过一年。另一名患者的缓解即将得到确认。
大部分患者在接受TILs治疗后,肿瘤病灶都有所缩小,在接受治疗后的第一次CT扫描时,肿瘤病灶直径平均缩小38%!
其实,早在2019年6月,FDA批准肿瘤浸润淋巴细胞(TIL)治疗方法LN-145为突破性的治疗指定,这是用于实体瘤的细胞免疫疗法首次获此殊荣,相信距离上市也仅是时间问题,一旦FDA批准,这将是首款用于实体瘤的细胞免疫疗法,将给癌症患者带来巨大的生存获益。
FDA此次授予是基于正在进行的第二阶段innovaTIL-04(C-145-04)积极的试验的数据,摘要数据显示,晚期宫颈癌患者的TIL治疗总体反应率(ORR)为44%,疾病控制率为89%!
|
|
|
GP2的肿瘤疫苗 |
在今年2020年圣东安尼奥乳腺癌专题讨论会(SABCS)上展示了一张5年随访乳腺癌患者的结果图,顿时火遍整个癌友圈。这款被称为GP2的肿瘤疫苗,以一骑绝尘之势引起极大的轰动,5年随访,乳腺癌复发率为0%,让我们看到了肿瘤临床治愈的曙光!
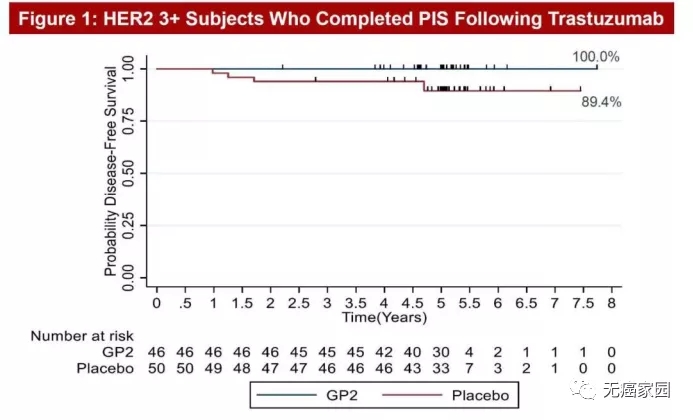
图中非常直观的能够看到,在5年随访后,46例HER2+患者接受GP2+GM-CSF(粒细胞-巨噬细胞集落刺激因子,FDA批准的免疫佐剂)治疗后,5年无病生存率(DFS)为100%,无一例复发!而单纯接受GM-CSF治疗的50例安慰剂患者的5年DFS发生率为89.4%。
GP2疫苗在无严重不良事件的情况下表现出良好的耐受性,并通过局部皮肤试验和免疫试验获得了强有力的免疫应答。
|
|
2021 |
|
|